Hidrógeno
El hidrógeno (en griego, de ὕδωρ hýdōr, genitivo ὑδρός hydrós, y γένος génos «que genera o produce agua») es el elemento químico de número atómico 1, representado por el símbolo H. Con una masa atómica de 1.00784,[1] es el más ligero de la tabla periódica de los elementos. Por lo general, se presenta en su forma molecular, formando el gas diatómico H2 en condiciones normales. Este gas es inflamable, incoloro, inodoro, no metálico e insoluble en agua.[2]
Debido a sus distintas y variadas propiedades, el hidrógeno no se puede encuadrar claramente en ningún grupo de la tabla periódica, aunque muchas veces se sitúa en el grupo 1 (o familia 1A) por poseer un solo electrón en la capa de valencia o capa superior.
El hidrógeno es el elemento químico más abundante, al constituir aproximadamente el 75 % de la materia visible del universo.[3][nota 1] En su secuencia principal, las estrellas están compuestas principalmente por hidrógeno en estado de plasma. El hidrógeno elemental es relativamente raro en la Tierra y es producido industrialmente a partir de hidrocarburos como, por ejemplo, el metano. La mayor parte del hidrógeno elemental se obtiene in situ, es decir, en el lugar y en el momento en que se necesita. Los mayores mercados del mundo disfrutan de la utilización del hidrógeno para el mejoramiento de combustibles fósiles (en el proceso de hidrocraqueo) y en la producción de amoniaco (principalmente para el mercado de fertilizantes). El hidrógeno puede obtenerse a partir del agua por un proceso de electrólisis, pero resulta un método mucho más caro que la obtención a partir del gas natural.[4]
El isótopo del hidrógeno más común es el protio, cuyo núcleo está formado por un único protón y ningún neutrón. En los compuestos iónicos, puede tener una carga positiva (convirtiéndose en un catión llamado hidrón, H+, compuesto únicamente por un protón, a veces en presencia de 1 o 2 neutrones); o carga negativa (convirtiéndose en un anión conocido como hidruro, H-). También se pueden formar otros isótopos, como el deuterio, con un neutrón, y el tritio, con dos neutrones. En 2001, fue creado en laboratorio el isótopo 4H y, a partir de 2003, se sintetizaron los isótopos 5H hasta 7H.[5][6] El hidrógeno forma compuestos con la mayoría de los elementos y está presente en el agua y en la mayoría de los compuestos orgánicos. Tiene un papel particularmente importante en la química ácido-base, en la que muchas reacciones implican el intercambio de protones (iones hidrógeno, H+) entre moléculas solubles. Puesto que es el único átomo neutro para el que se puede resolver analíticamente la ecuación de Schrödinger, el estudio de la energía y del enlace del átomo de hidrógeno ha sido fundamental hasta el punto de haber desempeñado un papel principal en el desarrollo de la mecánica cuántica.
Las características de este elemento y su solubilidad en diversos metales son muy importantes en la metalurgia, puesto que muchos metales pueden sufrir fragilidad en su presencia,[7] y en el desarrollo de formas seguras de almacenarlo para su uso como combustible.[8] Es altamente soluble en diversos compuestos que poseen tierras raras y metales de transición,[9] y puede ser disuelto tanto en metales cristalinos como amorfos.[10] La solubilidad del hidrógeno en los metales está influenciada por las distorsiones locales o impurezas en la estructura cristalina del metal.[11]
Etimología
[editar]El término hidrógeno proviene del latín hydrogenium, y este del griego antiguo ὕδωρ (hydro): ‘agua’ y γένος-ου(genos): ‘generador’; es decir, «productor de agua». Fue ese el nombre con el que lo bautizó Antoine Lavoisier. La palabra puede referirse tanto al átomo de hidrógeno, descrito en este artículo, como a la molécula diatómica (H2), que se encuentra a nivel de trazas en la atmósfera terrestre. Los químicos tienden a referirse a esta molécula como dihidrógeno,[12] molécula de hidrógeno, o hidrógeno diatómico, para distinguirla del átomo del elemento, que no existe de forma aislada en las condiciones ordinarias.
Historia
[editar]Descubrimiento del hidrógeno y uso
[editar]
El hidrógeno diatómico gaseoso, H2, fue el primero producido artificialmente y formalmente descrito por T. von Hohenheim (Paracelso), que lo obtuvo artificialmente mezclando metales con ácidos fuertes. Paracelso no era consciente de que el gas inflamable generado en estas reacciones químicas estaba compuesto por un nuevo elemento químico. En 1671, Robert Boyle redescubrió y describió la reacción que se producía entre limaduras de hierro y ácidos diluidos, lo que resulta en la producción de gas hidrógeno.[13] En 1766, Henry Cavendish fue el primero en reconocer el hidrógeno gaseoso como una sustancia discreta, identificando el gas producido en la reacción metal-ácido como «aire inflamable» y descubriendo más profundamente, en 1781, que el gas produce agua cuando se quema. Generalmente, se le da el crédito por su descubrimiento como un elemento químico.[14][15] En 1783, Antoine Lavoisier dio al elemento el nombre de hidrógeno (del griego υδρώ (hydro), agua y γένος-ου (genes) generar, es decir, «productor de agua»)[16][17] cuando él y Laplace reprodujeron el descubrimiento de Cavendish, donde se produce agua cuando se quema hidrógeno.[15]
Lavoisier produjo hidrógeno para sus experimentos sobre conservación de la masa haciendo reaccionar un flujo de vapor con hierro metálico a través de un tubo de hierro incandescente calentado al fuego. La oxidación anaerobia de hierro por los protones del agua a alta temperatura puede ser representada esquemáticamente por el conjunto de las siguientes reacciones:
- Fe + H2O → FeO + H2
- 2 Fe + 3 H2O → Fe2O3 + 3 H2
- 3 Fe + 4 H2O → Fe3O4 + 4 H2
Muchos metales, tales como circonio, se someten a una reacción similar con agua, lo que conduce a la producción de hidrógeno.
El hidrógeno fue licuado por primera vez por James Dewar en 1898 al usar refrigeración regenerativa, y su invención se aproxima mucho a lo que conocemos hoy en día como termo.[15] Produjo hidrógeno sólido al año siguiente.[15] El deuterio fue descubierto en diciembre de 1931 por Harold Urey, y el tritio fue preparado en 1934 por Ernest Rutherford, Marcus Oliphant, y Paul Harteck.[14] El agua pesada, que tiene deuterio en lugar de hidrógeno regular en la molécula de agua, fue descubierta por el equipo de Urey en 1932.[15]
François Isaac de Rivaz construyó el primer dispositivo de combustión interna propulsado por una mezcla de hidrógeno y oxígeno en 1806. Edward Daniel Clarke inventó el rebufo de gas de hidrógeno en 1819. La lámpara de Döbereiner y la Luminaria Drummond fueron inventadas en 1823.[15]
El llenado del primer globo con gas hidrógeno fue documentado por Jacques Charles en 1783.[15] El hidrógeno proveía el ascenso a la primera manera confiable de viajes aéreos después de la invención del primer dirigible de hidrógeno retirado en 1852 por Henri Giffard.[15] El conde alemán Ferdinand von Zeppelin promovió la idea de utilizar el hidrógeno en dirigibles rígidos, que más tarde fueron llamados zepelines, el primero de los cuales tuvo su vuelo inaugural en 1900.[15] Los vuelos normales comenzaron en 1910, y para el inicio de la Primera Guerra Mundial, en agosto de 1914, se había trasladado a 35 000 pasajeros sin ningún incidente grave. Los dirigibles elevados con hidrógeno se utilizan como plataformas de observación y bombarderos durante la guerra.[18]
La primera travesía transatlántica sin escalas fue hecha por el dirigible británico R34 en 1919. A partir de 1928, con el Graf Zeppelin LZ 127,[19] el servicio regular de pasajeros prosiguió hasta mediados de la década de 1930 sin ningún incidente. Con el descubrimiento de las reservas de otro tipo de gas ligero en los Estados Unidos, este proyecto debió ser modificado, ya que el otro elemento prometió más seguridad, pero el Gobierno de Estados Unidos se negó a vender el gas a tal efecto. Por lo tanto, el H2 fue utilizado en el dirigible Hindenburg, que resultó destruido en un incidente en vuelo sobre Nueva Jersey el 6 de mayo de 1937.[15] El incidente fue transmitido en vivo por radio y filmado. El encendido de una fuga de hidrógeno se atribuyó como la causa del incidente, pero las investigaciones posteriores señalaron a la ignición del revestimiento de tejido aluminizado por la electricidad estática.
Papel del hidrógeno en la teoría cuántica
[editar]
Gracias a su estructura atómica relativamente simple, consistente en un solo protón y un solo electrón para el isótopo más abundante (protio), el átomo de hidrógeno posee un espectro de absorción que pudo ser explicado cuantitativamente, lo que supuso el punto central del modelo atómico de Bohr, que constituyó un hito en el desarrollo la teoría de la estructura atómica. Además, la consiguiente simplicidad de la molécula de hidrógeno diatómico y el correspondiente catión dihidrógeno, H2+, permitió una comprensión más completa de la naturaleza del enlace químico, que continuó poco después con el tratamiento mecano-cuántico del átomo de hidrógeno, que había sido desarrollado a mediados de la década de 1920 por Erwin Schrödinger y Werner Heisenberg.
Uno de los primeros efectos cuánticos que fue explícitamente advertido (pero no entendido en ese momento) fue una observación de Maxwell en la que estaba involucrado el hidrógeno, medio siglo antes de que se estableciera completamente la teoría mecano-cuántica. Maxwell observó que el calor específico del H2, inexplicablemente, se desviaba del correspondiente a un gas diatómico por debajo de la temperatura ambiente y comenzaba a parecerse cada vez más al correspondiente a un gas monoatómico a temperaturas muy bajas. De acuerdo con la teoría cuántica, este comportamiento resulta del espaciamiento de los niveles energéticos rotacionales (cuantizados), que se encuentran particularmente separados en el H2 debido a su pequeña masa. Estos niveles tan separados impiden el reparto equitativo de la energía calorífica para generar movimiento rotacional en el hidrógeno a bajas temperaturas. Los gases diatómicos compuestos de átomos pesados no poseen niveles energéticos rotacionales tan separados y, por tanto, no presentan el mismo efecto que el hidrógeno.[20]
Abundancia en la naturaleza
[editar]
El hidrógeno es el elemento químico más abundante del universo, suponiendo más del 75 % en materia normal por masa y más del 90 % en número de átomos.[21] Este elemento se encuentra en abundancia en las estrellas y los planetas gaseosos gigantes. Las nubes moleculares de H2 están asociadas a la formación de las estrellas. El hidrógeno también juega un papel fundamental como combustible de las estrellas por medio de las reacciones de fusión nuclear entre núcleos de hidrógeno.
En el universo, el hidrógeno se encuentra principalmente en su forma atómica y en estado de plasma, cuyas propiedades son bastante diferentes a las del hidrógeno molecular. Como plasma, el electrón y el protón del hidrógeno no se encuentran ligados, por lo que presenta una alta conductividad eléctrica y una gran emisividad (origen de la luz emitida por el Sol y otras estrellas). Las partículas cargadas están fuertemente influenciadas por los campos eléctricos y magnéticos. Por ejemplo, en los vientos solares las partículas interaccionan con la magnetosfera terrestre generando corrientes de Birkeland y el fenómeno de las auroras.
Bajo condiciones normales de presión y temperatura, el hidrógeno existe como gas diatómico, H2. Sin embargo, el hidrógeno gaseoso es extremadamente poco abundante en la atmósfera de la Tierra (1 ppm en volumen), debido a su pequeña masa que le permite escapar al influjo de la gravedad terrestre más fácilmente que otros gases más pesados. Aunque los átomos de hidrógeno y las moléculas diatómicas de hidrógeno abundan en el espacio interestelar, son difíciles de generar, concentrar y purificar en la Tierra. El hidrógeno es el decimoquinto elemento más abundante en la superficie terrestre[22] La mayor parte del hidrógeno terrestre se encuentra formando parte de compuestos químicos tales como los hidrocarburos o el agua.[23] El hidrógeno gaseoso es producido por algunas bacterias y algas, y es un componente natural de las flatulencias.
Propiedades
[editar]Combustión
[editar]
El gas hidrógeno (dihidrógeno[24]) es altamente inflamable y se quema en concentraciones de 4 % o más H2 en el aire.[25] La entalpía de combustión de hidrógeno es −285.8 kJ/mol;[26] se quema de acuerdo con la siguiente ecuación balanceada.
- 2 H2(g) + O2(g) → 2 H2O(l) + 572 kJ (285.8 kJ/mol)[27]
Cuando se mezcla con oxígeno en una variedad de proporciones, de hidrógeno explota por ignición. El hidrógeno se quema violentamente en el aire; se produce la ignición automáticamente a una temperatura de 560 °C.[28] Llamas de hidrógeno-oxígeno puros se queman en la gama del color ultravioleta y son casi invisibles a simple vista, como lo demuestra la debilidad de la llama de los motores principales del transbordador espacial (a diferencia de las llamas fácilmente visibles del cohete acelerador del sólido). Así que se necesita un detector de llama para detectar si una fuga de hidrógeno está ardiendo. La explosión del dirigible Hindenburg fue un caso infame de combustión de hidrógeno. La causa fue debatida, pero los materiales combustibles en la cubierta de la aeronave fueron los responsables del color de las llamas.[29] Otra característica de los fuegos de hidrógeno es que las llamas tienden a ascender rápidamente con el gas en el aire, como ilustraron las llamas del Hindenburg, causando menos daño que los fuegos de hidrocarburos. Dos terceras partes de los pasajeros del Hindenburg sobrevivieron al incendio, y muchas de las muertes que se produjeron fueron por caída o fuego del combustible diésel.[30]
H2 reacciona directamente con otros elementos oxidantes. Una reacción espontánea y violenta puede ocurrir a temperatura ambiente con cloro y flúor, formando los haluros de hidrógeno correspondientes: cloruro de hidrógeno y fluoruro de hidrógeno.[31]
A diferencia de los hidrocarburos, la combustión del hidrógeno no genera óxidos de carbono (monóxido y dióxido) sino simplemente agua en forma de vapor, por lo que se considera un combustible amigable con el medio ambiente y ayuda a mitigar el calentamiento global.
Niveles energéticos electrónicos
[editar]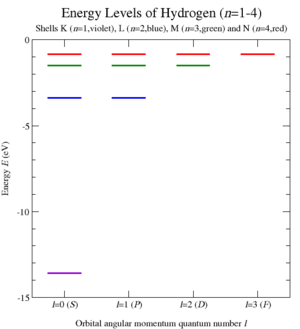

El nivel energético del estado fundamental electrónico de un átomo de hidrógeno es –13.6 eV, que equivale a un fotón ultravioleta de, aproximadamente, 92 nm de longitud de onda.
Los niveles energéticos del hidrógeno pueden calcularse con bastante precisión empleando el modelo atómico de Bohr, que considera que el electrón orbita alrededor del protón de forma análoga a la órbita terrestre alrededor del Sol. Sin embargo, la fuerza electromagnética hace que el protón y el electrón se atraigan, de igual modo que los planetas y otros cuerpos celestes se atraen por la fuerza gravitatoria. Debido al carácter discreto (cuantizado) del momento angular postulado en los inicios de la mecánica cuántica por Bohr, el electrón en el modelo de Bohr solo puede orbitar a ciertas distancias permitidas alrededor del protón y, por extensión, con ciertos valores de energía permitidos. Una descripción más precisa del átomo de hidrógeno viene dada mediante un tratamiento puramente mecano-cuántico que emplea la ecuación de onda de Schrödinger o la formulación equivalente de las integrales de camino de Feynman para calcular la densidad de probabilidad del electrón cerca del protón.[32] El tratamiento del electrón a través de la hipótesis de De Broglie (dualidad onda--partícula) reproduce resultados químicos (tales como la configuración del átomo de hidrógeno) de manera más natural que el modelo de partículas de Bohr, aunque la energía y los resultados espectrales son los mismos. Si en la construcción del modelo se emplea la masa reducida del núcleo y del electrón (como se haría en el problema de dos cuerpos en Mecánica Clásica), se obtiene una mejor formulación para los espectros del hidrógeno, y los desplazamientos espectrales correctos para el deuterio y el tritio. Pequeños ajustes en los niveles energéticos del átomo de hidrógeno, que corresponden a efectos espectrales reales, pueden determinarse usando la teoría mecano-cuántica completa, que corrige los efectos de la relatividad especial (ver ecuación de Dirac), y computando los efectos cuánticos originados por la producción de partículas virtuales en el vacío y como resultado de los campos eléctricos (ver Electrodinámica Cuántica).
En el hidrógeno gaseoso, el nivel energético del estado electrónico fundamental está dividido a su vez en otros niveles de estructura hiperfina, originados por el efecto de las interacciones magnéticas producidas entre los espines del electrón y del protón. La energía del átomo cuando los espines del protón y del electrón están alineados es mayor que cuando los espines no lo están. La transición entre esos dos estados puede tener lugar mediante la emisión de un fotón a través de una transición de dipolo magnético. Los radiotelescopios pueden detectar la radiación producida en este proceso, lo que sirve para crear mapas de distribución del hidrógeno en la galaxia.
Formas elementales moleculares
[editar]
Existen dos tipos distintos de moléculas diatómicas de hidrógeno que difieren en la relación entre los espines de sus núcleos:[33] Mientras que en la forma de ortohidrógeno, los espines de los dos protones son paralelos y forman un estado triplete, en forma de para-hidrógeno, los spins son antiparalelos y forman un singular. En condiciones normales de presión y temperatura, el hidrógeno gaseoso contiene aproximadamente un 25 % de la forma para y un 75 % de la forma orto, también conocida como «forma normal».[34] La relación del equilibrio entre ortohidrógeno y para-hidrógeno depende de la temperatura, pero puesto que la forma orto es un estado excitado y por tanto posee una energía superior, y además es inestable y no puede ser purificado. A temperaturas muy bajas, el estado de equilibrio está compuesto casi exclusivamente por la forma para. Las propiedades físicas del para-hidrógeno puro difieren ligeramente de las de la forma normal (orto).[35] La distinción entre formas orto/para también se presenta en otras moléculas o grupos funcionales que contienen hidrógeno, tales como el agua o el metileno.
La interconversión no catalizada entre el para-hidrógeno y el ortohidrógeno se incrementa al aumentar la temperatura; por esta razón, el H2 condensado rápidamente contiene grandes cantidades de la forma orto que pasa a la forma para lentamente.[36] La relación orto/para en el H2 condensado es algo importante a tener en cuenta para la preparación y el almacenamiento del hidrógeno líquido: la conversión de la forma orto a la forma para es exotérmica y produce el calor suficiente para evaporar el hidrógeno líquido, provocando la pérdida del material licuado. Catalizadores para la interconversión orto/para, tales como compuestos de hierro, son usados en procesos de refrigeración con hidrógeno.[37]
Una forma molecular llamada hidrógeno molecular protonado, H3+, se encuentra en el medio interestelar, donde se genera por la ionización del hidrógeno molecular provocada por los rayos cósmicos. También se ha observado en las capas superiores de la atmósfera de Júpiter. Esta molécula es relativamente estable en el medio del espacio exterior debido a las bajas temperaturas y a la bajísima densidad. El H3+ es uno de los iones más abundantes del universo, y juega un papel notable en la química del medio interestelar.[38]
Hidrógeno metálico
[editar]Si bien se suele catalogar al hidrógeno como no metal, a altas temperaturas y presiones puede comportarse como metal. En marzo de 1996, un grupo de científicos del Laboratorio Nacional Lawrence Livermore informó de que habían producido casualmente, durante un microsegundo y a temperaturas de miles de kelvins y presiones de más de un millón de atmósferas (> 100 GPa), el primer hidrógeno metálico identificable.[39]
Compuestos
[editar]Compuestos covalentes y orgánicos
[editar]A pesar de que el H2 no es muy reactivo en condiciones normales, forma multitud de compuestos con la mayoría de los elementos químicos. Se conocen millones de hidrocarburos, pero no se generan por la reacción directa del hidrógeno elemental con el carbono (aunque la producción del gas de síntesis seguida del proceso Fischer-Tropsch para sintetizar hidrocarburos parece ser una excepción pues comienza con carbón e hidrógeno elemental generado in situ). El hidrógeno puede formar compuestos con elementos más electronegativos, tales como los halógenos (flúor, cloro, bromo, yodo) o los calcógenos (oxígeno, azufre, selenio); en estos compuestos, el hidrógeno adquiere carga parcial positiva debido a la polaridad del enlace covalente. Cuando se encuentra unido al flúor, al oxígeno o al nitrógeno, el hidrógeno puede participar en una modalidad de enlace no covalente llamado «enlace de hidrógeno» o «puente de hidrógeno», que es fundamental para la estabilidad de muchas moléculas biológicas. El hidrógeno puede también formar compuestos con elementos menos electronegativos, tales como metales o semimetales, en los cuales adquiere carga parcial negativa. Estos compuestos se conocen como hidruros.
El hidrógeno forma una enorme variedad de compuestos con el carbono. Debido a su presencia en los seres vivos, estos compuestos se denominan compuestos orgánicos; el estudio de sus propiedades es la finalidad de la Química Orgánica, y el estudio en el contexto de los organismos vivos se conoce como Bioquímica. Atendiendo a algunas definiciones, los compuestos «orgánicos» requieren la presencia de carbono para ser denominados así (ahí tenemos el clásico ejemplo de la urea) pero no todos los compuestos de carbono se consideran orgánicos (es el caso del monóxido de carbono, o los carbonatos metálicos. La mayoría de los compuestos orgánicos también contienen hidrógeno y, puesto que es el enlace carbono-hidrógeno el que proporciona a estos compuestos muchas de sus principales características, se hace necesario mencionar el enlace carbono-hidrógeno en algunas definiciones de la palabra «orgánica» en Química. (Estas recientes definiciones no son perfectas, sin embargo, ya que un compuesto indudablemente orgánico como la urea no podría ser catalogado como tal atendiendo a ellas).
En la Química Inorgánica, los hidruros pueden servir también como ligandos puente que unen dos centros metálicos en un complejo de coordinación. Esta función es particularmente común en los elementos del grupo 13, especialmente en los boranos (hidruros de boro) y en los complejos de aluminio, así como en los clústers de carborano.[23]
Algunos ejemplos de compuestos covalentes importantes que contienen hidrógeno son: amoniaco (NH3), hidracina (N2H4), agua (H2O), peróxido de hidrógeno (H2O2), sulfuro de hidrógeno (H2S), etc.
Hidruros
[editar]A menudo los compuestos del hidrógeno se denominan hidruros, un término usado con bastante inexactitud. Para los químicos, el término «hidruro» generalmente implica que el átomo de hidrógeno ha adquirido carga parcial negativa o carácter aniónico (denotado como H-). La existencia del anión hidruro, propuesta por G. N. Lewis en 1916 para los hidruros iónicos del grupo 1 (I) y 2 (II), fue demostrada por Moers en 1920 con la electrólisis del hidruro de litio (LiH) fundido, que producía una cantidad estequiométrica de hidrógeno en el ánodo.[40] Para los hidruros de metales de otros grupos, el término es bastante erróneo, considerando la baja electronegatividad del hidrógeno. Una excepción en los hidruros del grupo II es el BeH2, que es polimérico. En el tetrahidruroaluminato (III) de litio, el anión AlH4- posee sus centros hidrúricos firmemente unidos al aluminio (III).

Aunque los hidruros pueden formarse con casi todos los elementos del grupo principal, el número y combinación de posibles compuestos varía mucho; por ejemplo, existen más de 100 hidruros binarios de boro conocidos, pero solamente uno de aluminio.[41] El hidruro binario de indio no ha sido identificado aún, aunque existen complejos mayores.[42]
«Protones» y ácidos
[editar]La oxidación del H2 formalmente origina el protón, H+. Esta especie es fundamental para explicar las propiedades de los ácidos, aunque el término «protón» se usa imprecisamente para referirse al hidrógeno catiónico o ion hidrógeno, denotado H+. Un protón aislado H+ no puede existir en disolución debido a su fuerte tendencia a unirse a átomos o moléculas con electrones mediante un enlace coordinado o enlace dativo. Para evitar la cómoda, aunque incierta, idea del protón aislado solvatado en disolución, en las disoluciones ácidas acuosas se considera la presencia del ion hidronio (H3O+) organizado en clústers para formar la especie H9O4+.[43] Otros iones oxonio están presentes cuando el agua forma disoluciones con otros disolventes.[44]
Aunque exótico en la Tierra, uno de los iones más comunes en el universo es el H3+, conocido como hidrógeno molecular protonado o catión hidrógeno triatómico.[45]
Isótopos
[editar]



El isótopo más común de hidrógeno no posee neutrones, existiendo otros dos, el deuterio (D) con uno y el tritio (T), radiactivo con dos. El deuterio tiene una abundancia natural comprendida entre 0.0184 y 0.0082 % (Unión Internacional de Química Pura y Aplicada (IUPAC)). El hidrógeno es el único elemento químico que tiene nombres y símbolos químicos distintos para sus diferentes isótopos.
El hidrógeno también posee otros isótopos altamente inestables (del 4H al 7H), que fueron sintetizados en el laboratorio, pero nunca observados en la naturaleza.[5][6]
- 1H, conocido como protio, es el isótopo más común del hidrógeno con una abundancia de más del 99.98 %. Debido a que el núcleo de este isótopo está formado por un solo protón se le ha bautizado como protio, nombre que a pesar de ser muy descriptivo, es poco usado.
- ²H, el otro isótopo estable del hidrógeno, es conocido como deuterio y su núcleo contiene un protón y un neutrón. El deuterio representa el 0.0026 % o el 0.0184 % (según sea en fracción molar o fracción atómica) del hidrógeno presente en la Tierra, encontrándose las menores concentraciones en el hidrógeno gaseoso, y las mayores (0.015 % o 150 ppm) en aguas oceánicas. El deuterio no es radiactivo, y no representa un riesgo significativo de toxicidad. El agua enriquecida en moléculas que incluyen deuterio en lugar de hidrógeno 1H (protio), se denomina agua pesada. El deuterio y sus compuestos se emplean en marcado no radiactivo en experimentos y también en disolventes usados en espectroscopia 1H - RMN. El agua pesada se utiliza como moderador de neutrones y refrigerante en reactores nucleares. El deuterio es también un potencial combustible para la fusión nuclear con fines comerciales.
- ³H se conoce como tritio y contiene un protón y dos neutrones en su núcleo. Es radiactivo, desintegrándose en ³2He+ a través de una emisión beta. Posee un periodo de semidesintegración de 12.33 años.[23] Pequeñas cantidades de tritio se encuentran en la naturaleza por efecto de la interacción de los rayos cósmicos con los gases atmosféricos. También ha sido liberado tritio por la realización de pruebas de armamento nuclear. El tritio se usa en reacciones de fusión nuclear, como trazador en Geoquímica Isotópica, y en dispositivos luminosos autoalimentados. Antes era común emplear el tritio como radiomarcador en experimentos químicos y biológicos, pero actualmente se usa menos.
El hidrógeno es el único elemento que posee diferentes nombres comunes para cada uno de sus isótopos (naturales). Durante los inicios de los estudios sobre la radiactividad, a algunos isótopos radiactivos pesados les fueron asignados nombres, pero ninguno de ellos se sigue usando. Los símbolos D y T (en lugar de ²H y ³H) se usan a veces para referirse al deuterio y al tritio, pero el símbolo P corresponde al fósforo y, por tanto, no puede usarse para representar al protio. La IUPAC declara que aunque el uso de estos símbolos sea común, no es lo aconsejado.
Reacciones biológicas
[editar]H2 es un producto de algunos tipos de metabolismo anaeróbico y es producido por diversos microorganismos, por lo general a través de reacciones catalizadas por enzimas que contienen hierro o níquel llamadas hidrogenasas. Estas enzimas catalizan la reacción redox reversible entre H2 y sus componentes, dos protones y dos electrones. La creación de gas de hidrógeno ocurre en la transferencia de reducir equivalentes producidos durante la fermentación del piruvato al agua.[46]
La separación del agua, en la que el agua se descompone en sus componentes, protones, electrones y oxígeno ocurre durante la fase clara en todos los organismos fotosintéticos. Algunos organismos —incluyendo el alga Chlamydomonas reinhardtii y cianobacteria— evolucionaron un paso más en la fase oscura en el que los protones y los electrones se reducen para formar gas de H2 por hidrogenasas especializadas en el cloroplasto.[47] Se realizaron esfuerzos para modificar genéticamente las hidrogenasas de cianobacterias para sintetizar de manera eficiente el gas H2 incluso en la presencia de oxígeno.[48] También se realizaron esfuerzos con algas modificadas genéticamente en un biorreactor.[49]
Producción
[editar]El gas H2 es producido en los laboratorios de química y biología, muchas veces como un subproducto de la deshidrogenación de sustratos insaturados; y en la naturaleza como medio de expulsar equivalentes reductores en reacciones bioquímicas.
Laboratorio
[editar]En el laboratorio, el gas H2 es normalmente preparado por la reacción de ácidos con metales tales como el zinc, por medio del aparato de Kipp.
El aluminio también puede producir H2 después del tratamiento con bases:
2 Al + 6 H2O + 2 OH- → 2 Al(OH)4- + 3 H2
La electrólisis del agua es un método simple de producir hidrógeno. Una corriente eléctrica de bajo voltaje fluye a través del agua, y el oxígeno gaseoso se forma en el ánodo, mientras que el gas hidrógeno se forma en el cátodo. Típicamente, el cátodo está hecho de platino u otro metal inerte (generalmente platino o grafito), cuando se produce hidrógeno para el almacenamiento. Si, sin embargo, el gas se destinara a ser quemado en el lugar, es deseable que haya oxígeno para asistir a la combustión, y entonces, ambos electrodos pueden estar hechos de metales inertes (se deben evitar los electrodos de hierro, ya que consumen oxígeno al sufrir oxidación). La eficiencia máxima teórica (electricidad utilizada vs valor energético de hidrógeno producido) es entre 80 y 94 %.[50]
En 2007, se descubrió que una aleación de aluminio y galio en forma de gránulos añadida al agua podía utilizarse para generar hidrógeno. El proceso también produce alúmina, pero se puede reutilizar el galio, que previene la formación de una película de óxido en los gránulos. Esto tiene importantes implicaciones para la potenciales economía basada en el hidrógeno, ya que se puede producir en el lugar y no tiene que ser transportado.[51]
Industrial
[editar]El hidrógeno puede ser preparado por medio de varios procesos pero hoy día el más importante consiste en la extracción de hidrógeno a partir de hidrocarburos. La mayor parte del hidrógeno comercial se produce mediante el reformado catalítico de gas natural[52] o de hidrocarburos líquidos. A altas temperaturas (700-1100 °C), se hace reaccionar vapor de agua con metano para producir monóxido de carbono y H2:
Esta reacción es favorecida termodinámicamente por un exceso de vapor y por bajas presiones pero normalmente se practica a altas presiones (20 atm) por motivos económicos. La mezcla producida se conoce como «gas de síntesis», ya que muchas veces se utiliza directamente para la síntesis de metanol y otras sustancias químicas. Se pueden usar otros hidrocarburos, además de metano, para producir gas de síntesis con proporciones variables de los productos.
Si el producto que se desea es solo hidrógeno, se hace reaccionar el monóxido de carbono a través de la reacción de desplazamiento del vapor de agua, por ejemplo con un catalizador de óxido de hierro. Esta reacción es también una fuente industrial común de dióxido de carbono:[52]
Otras opciones para producir hidrógeno a partir de metano son la pirólisis, que resulta en la formación de carbono sólido:
O la oxidación parcial,[53] la cual se aplica también a combustibles como el carbón:
Otro proceso que produce hidrógeno como producto secundario es la electrólisis de salmuera para producir cloro.[54]
Termoquímicos solares
[editar]Existen más de 200 ciclos termoquímicos que pueden ser utilizados para la separación del agua, alrededor de una docena de estos ciclos, tales como el ciclo de óxido de hierro, ciclo del óxido cerio (III)-óxido cerio(IV), ciclo de óxido zinc-zinc, ciclo del azufre-yodo, ciclo del cobre-cloro, ciclo híbrido del azufre están bajo investigación y en fase de prueba para producir hidrógeno y oxígeno a partir de agua y calor sin utilizar electricidad.[55] Un número de laboratorios (incluyendo Francia, Alemania, Grecia, Japón y los Estados Unidos) están desarrollando métodos termoquímicos para producir hidrógeno a partir de energía solar y agua.[56]
Corrosión anaerobia
[editar]En condiciones anaeróbicas, las aleaciones de hierro y acero se oxidan lentamente por los protones de agua concomitante reducidos en hidrógeno molecular (H2). La corrosión anaeróbica de hierro conduce primero a la formación de hidróxido ferroso (óxido verde) y se puede describir mediante la siguiente reacción:
- Fe + 2 H2O → Fe(OH)2 + H2
A su vez, bajo condiciones anaeróbicas, el hidróxido ferroso (Fe(OH)2 ) puede ser oxidado por los protones de agua para formar magnetita e hidrógeno molecular. Este proceso se describe por la reacción de Schikorr:
- 3 Fe(OH)2 → Fe3O4 + 2 H2O + H2
- hidróxido ferroso → magnetita + agua + hidrógeno
La magnetita así cristalizada (Fe3O4) es termodinámicamente más estable que el hidróxido ferroso (Fe(OH)2 ).
Este proceso ocurre durante la corrosión anaeróbica de hierro y acero en aguas subterráneas sin oxígeno y en suelos reducidos por debajo del nivel freático.
Ocurrencia geológica: la reacción de serpentinización
[editar]En ausencia de oxígeno atmosférico (O2), en condiciones geológicas profundas que prevalezcan lejos de atmósfera de la Tierra, el hidrógeno (H2) se produce durante el proceso del serpentinización por la oxidación anaeróbica de protones del agua (H+) del silicato ferroso (Fe2+) presente en la red cristalina de la fayalita (Fe2SiO4, el hierro olivino). La reacción correspondiente que conduce a la formación de magnetita (Fe3O4), cuarzo SiO2) e hidrógeno (H2) es la siguiente:
- 3 Fe2SiO4 + 2 H2O → 2 Fe3O4 + 3 SiO2 + 3 H2
- fayalita + agua → magnetita + cuarzo + hidrógeno
Esta reacción se parece mucho a la reacción de Schikorr observada en la oxidación anaeróbica del hidróxido ferroso en contacto con el agua.
Formación en transformadores
[editar]De todos los gases de fallo formados en transformadores eléctricos, el hidrógeno es el más común y se genera bajo la mayoría de condiciones de fallo, por lo que, la formación de hidrógeno es un primer indicio de problemas graves en el ciclo de vida del transformador.[57]
Aplicaciones
[editar]Industria petroquímica
[editar]Se necesitan grandes cantidades de H2 en las industrias del petróleo y química. Una aplicación adicional de H2 es de tratamiento («mejoramiento») de combustibles fósiles, y en la producción de amoniaco. Los principales consumidores de H2 en una planta petroquímica incluyen hidrodesalquilación, hidrodesulfuración, y de hidrocraqueo. El H2 se utiliza como un agente hidrogenizante, particularmente en el aumento del nivel de saturación de las grasas y aceites insaturados (que se encuentran en artículos como la margarina) y en la producción de metanol. Del mismo modo es la fuente de hidrógeno en la fabricación de ácido clorhídrico. El H2 también se utiliza como agente reductor de minerales metálicos.[58]
Además de su uso como un reactivo, H2 tiene amplias aplicaciones en la física y la ingeniería. Se utiliza como gas de protección en los métodos de soldadura tales como la soldadura de hidrógeno atómico.[59][60] H2 se utiliza como un enfriador de generadores en centrales eléctricas, porque tiene la mayor conductividad térmica de todos los gases. H2 líquido se utiliza en la investigaciones criogénicas, incluyendo estudios de superconductividad.[61] Dado que el H2 es más ligero que el aire, teniendo un poco más de 1/15 de la densidad del aire, fue ampliamente utilizado en el pasado como gas de elevación en globos aerostáticos y dirigibles.[62]
En aplicaciones más recientes, se utiliza hidrógeno puro o mezclado con nitrógeno (a veces llamado forming gas) como gas indicador para detectar fugas. Las aplicaciones pueden ser encontradas en las industrias automotriz, química, de generación de energía, aeroespacial y de telecomunicaciones.[63] El hidrógeno es un aditivo alimentario autorizado (E 949) que permite la prueba de fugas de paquetes, entre otras propiedades antioxidantes.[64]
Los isótopos más raros de hidrógeno también poseen aplicaciones específicas para cada uno. El deuterio (hidrógeno-2) se utiliza en aplicaciones de la fisión nuclear como un moderador para neutrones lentos, y en las reacciones de fusión nuclear.[15] Los compuestos de deuterio tienen aplicaciones en la química y biología en los estudios de los efectos isotópicos.[65] El tritio (hidrógeno-3), producido en los reactores nucleares, se utiliza en la producción de bombas de hidrógeno,[66] como un marcador isotópico en las ciencias biológicas,[67] como una fuente de radiación en pinturas luminosas.[68]
La temperatura de equilibrio del punto triple de hidrógeno es un punto fijo definido en la escala de temperatura ITS-90 a 13.8033 Kelvin.[69]
Portador de energía
[editar]El hidrógeno no es una fuente de energía,[70] excepto en el contexto hipotético de las centrales nucleares de fusión comerciales que utilizan deuterio o tritio, una tecnología actualmente lejos de desarrollo.[71] La energía del sol proviene de la fusión nuclear del hidrógeno, pero este proceso es difícil de lograr de forma controlable en la Tierra.[72] El hidrógeno elemental de fuentes solares, biológicas, o eléctricas requieren más energía para crear lo que es obtenido al quemarlo, por lo que, en estos casos, sirve el hidrógeno como portador de energía, como una batería. Se puede obtener a partir de fuentes fósiles (tales como metano), pero estas fuentes son insustentables.[70]
La densidad de energía por unidad de volumen tanto del hidrógeno líquido como del gas de hidrógeno comprimido en cualquier presión posible es significativamente menor que aquella de fuentes de combustible tradicionales, aunque la densidad de energía por unidad de masa de combustible sea más alta.[70] Sin embargo, el hidrógeno elemental ha sido ampliamente discutido en el contexto de la energía, como un posible portador de energía futura a gran escala de la economía.[73] Por ejemplo, el secuestro de CO2 seguido de captura y almacenamiento de carbono podría realizarse al punto de producción de H2 a partir de combustibles fósiles.[74] El hidrógeno utilizado en el transporte se quemaría relativamente limpio, con algunas emisiones de NOx,[75] pero sin emisiones de carbono.[74] Sin embargo, los costos de infraestructura asociados con la conversión total a una economía del hidrógeno podría ser sustancial.[76][77]
Industria de semiconductores
[editar]El hidrógeno es empleado para saturar enlaces rotos de silicio amorfo y carbono amorfo que ayuda a la estabilización de las propiedades del material.[78] Es también un potencial donante de electrones en diferentes materiales óxidos, incluyendo ZnO,[79][80] SnO2, CdO, MgO,[81] ZrO2, HfO2, La2O3, Y2O3, TiO2, SrTiO3, LaAlO3, SiO2, Al2O3, ZrSiO4, HfSiO4, y SrZrO3.[82]
Seguridad y precauciones
[editar]
El hidrógeno genera diversos riesgos para la seguridad humana, de potenciales detonaciones e incendios cuando se mezcla con el aire al ser un asfixiante en su forma pura, libre de oxígeno.[83] Además, el hidrógeno líquido es un criogénico y presenta peligros (tales como congelación) asociados con líquidos muy fríos.[84] El elemento se disuelve en algunos metales y, además de fuga, pueden tener efectos adversos sobre ellos, tales como fragilización por hidrógeno.[85] La fuga de gas de hidrógeno en el aire externo puede inflamarse espontáneamente. Por otra parte, el fuego de hidrógeno, siendo extremadamente caliente, es casi invisible, y por lo tanto puede dar lugar a quemaduras accidentales.[86]
Aunque incluso interpretar los datos de hidrógeno (incluyendo los datos para la seguridad) es confundido por diversos fenómenos. Muchas de las propiedades físicas y químicas del hidrógeno dependen de la tasa de parahidrógeno/ortohidrógeno (por lo general llevar a días o semanas a una temperatura determinada para llegar a la tasa de equilibrio por el cual los resultados suelen aparecer los parámetros de detonación de hidrógeno, como la presión y temperatura crítica de fundición, dependen en gran medida de la geometría del recipiente.[83]
Véase también
[editar]| Elementos diatómicos | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Hidrógeno |
| |
| |
Oxígeno |
| |
Flúor |
||||||||||||||||||||||||||||||||||||
|
Cloro |
| |
Bromo |
| |
Yodo |
| |
Ástato |
|||||||||||||||||||||||||||||||||||
Nota
[editar]- ↑ Sin embargo, la mayor parte de la masa del universo no está en la forma de bariones o elementos químicos. Véase materia oscura y energía oscura.
Referencias
[editar]- ↑ Christen, Hans Rudolf (1977). Química general. Reverte. ISBN 9788429171310. Consultado el 7 de agosto de 2018.
- ↑ Murphy, Ana Carolina (2009). «Hidrogênio é o Futuro». Revista Galileu, 2009 (en portugués). Archivado desde el original el 3 de marzo de 2016. Consultado el 26 de noviembre de 2013.
- ↑ Palmer, David (13 de septiembre). «Hydrogen in the Universe». NASA. Consultado el 1 de diciembre de 2008.
- ↑ Staff (2009). «Hydrogen Basics — Production». Florida Solar Energy Center. Consultado el 1º de diciembre de 2008.
- ↑ a b Gurov, Y. B., Aleshkin, D. V., Berh, M. N., Lapushkin, S. V., Morokhov, P. V., Pechkurov, V. A., Poroshin, N. O., Sandukovsky, V. G., Tel'kushev, M. V., Chernyshev, B. A., Tschurenkova, T. D. (2004). «Spectroscopy of superheavy hydrogen isotopes in stopped-pion absorption by nuclei.» Physics of Atomic Nuclei 68(3):491-497.
- ↑ a b Korsheninnikov, A. A. et al. (2003). «Experimental Evidence for the Existence of 7H and for a Specific Structure of 8He.» Phys Rev Lett 90, 082501.
- ↑ Rogers, H. C. (1999). «Hydrogen Embrittlement of Metals». Science 159 (3819): 1057-1064. ISSN 0036-8075. PMID 17775040. doi:10.1126/science.159.3819.1057.
- ↑ Christense, C. H.; Nørskov, J. K.; Johannessen, T. (9 de julio de 2005). «Making society independent of fossil fuels — Danish researchers reveal new technology». Technical University of Denmark. Archivado desde el original el 7 de enero de 2010. Consultado el 1º de diciembre de 2008.
- ↑ Takeshita, T.; Wallace, W. E.; Craig, R. S. (1974). «Hydrogen solubility in 1:5 compounds between yttrium or thorium and nickel or cobalt». Inorganic Chemistry 13 (9): 2282-2283. doi:10.1021/ic50139a050.
- ↑ Kirchheim, R.; Mutschele, T.; Kieninger, W. (1988). «Hydrogen in amorphous and nanocrystalline metals». Materials Science and Engineering 99: 457-462. doi:10.1016/0025-5416(88)90377-1.
- ↑ Kirchheim, R. (1988). «Hydrogen solubility and diffusivity in defective and amorphous metals». Progress in Materials Science 32 (4): 262-325. doi:10.1016/0079-6425(88)90010-2.
- ↑ Kubas, G. J., Metal Dihydrogen and σ-Bond Complexes. Kluwer Academic/Plenum Publishers: Nueva York, 2001.
- ↑ «Webelements – Hydrogen historical information». Consultado el 15 de septiembre de 2005.
- ↑ a b «Hydrogen». Van Nostrand's Encyclopedia of Chemistry. Wiley-Interscience. 2005. pp. 797-799. ISBN 0-471-61525-0.
- ↑ a b c d e f g h i j k Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. pp. 183-191. ISBN 0-19-850341-5.
- ↑ Stwertka, Albert (1996). A Guide to the Elements. Oxford University Press. pp. 16-21. ISBN 0-19-508083-1.
- ↑ Asimov, Isaac (2014). Breve historia de la química: Introducción a las ideas y conceptos de la química. Alianza Editorial (El Libro de Bolsillo). p. 83. ISBN 978-84-206-6421-7.
- ↑ Lehmann, Ernst A.; Mingos, Howard (1927). «1: German airships prepare for war». The Zeppelins: The Development of the Airship, with the Story of the Zepplins Air Raids in the World War. Archivado desde el original
|urlarchivo=requiere|url=(ayuda) el 30 de septiembre de 2008. Consultado el 6 de noviembre de 2009. - ↑ (En inglés.) «Graf Zeppelin History.» Airships.net. Consultado el 19 d mayo de 2016.
- ↑ Berman, R., Cooke, A. H., Hill, R. W. «Cryogenics.» Ann. Rev. Phys. Chem. 7 (1956). 1-20.
- ↑ «Jefferson Lab – Hydrogen». Consultado el 15 de septiembre de 2005.
- ↑ Shriver, D. F.; Atkins, P. W.; Langford, C. H. Química Inorgánica. Vol. 1. Segunda edición. Reverté. 1997.
- ↑ a b c Miessler, G. L., Tarr, D. A. (2004). Inorganic Chemistry 3rd ed. Pearson Prentice Hall: Upper Saddle River, NJ, USA.
- ↑ University of Southern Maine-Dihydrogen
- ↑ Carcassi, M. N.; Fineschi, F. (junio de 2005). «Deflagrations of H2–air and CH4–air lean mixtures in a vented multi-compartment environment». Energy 30 (8): 1439-1451. doi:10.1016/j.energy.2004.02.012.
- ↑ National Academy of Engineering, National Academy of Sciences (2004). The Hydrogen Economy: Opportunities, Costs,. National Academies Press. p. 240. ISBN 0309091632.
- ↑ Energía es por mol de material combustible, Hidrógeno. 286 kJ/mol
- ↑ Staff (10 de octubre). «Safety data for hydrogen». Chemical and Other Safety Information (en inglés). The Physical and Theoretical Chemistry Laboratory, Oxford University. Consultado el 15 de diciembre de 2008.
- ↑ Dziadecki, John (2005). «Hindenburg Hydrogen Fire» (en inglés). Consultado el 15 de diciembre de 2008.
- ↑ Werthmüller, Andreas. «The Hindenburg Disaster». Swiss Hydrogen Association. Archivado desde el original el 10 de febrero de 2008. Consultado el 15 de diciembre de 2008.
- ↑ Clayton, Donald D. (2003). Handbook of Isotopes in the Cosmos: Hydrogen to Gallium (en inglés). Cambridge University Press. ISBN 0521823811.
- ↑ Stern, David P. (13 de febrero). «Wave Mechanics». NASA Goddard Space Flight Center. Archivado desde el original el 21 de febrero de 2013. Consultado el 12 de diciembre de 2008.
- ↑ «Universal Industrial Gases, Inc. – Hydrogen (H2) Applications and Uses». Consultado el 15 de septiembre de 2005.
- ↑ Tikhonov, V. I., Volkov, A. A. (2002). «Separation of water into its ortho and para isomers.» Science 296(5577):2363.
- ↑ NASA Glenn Research Center Glenn Safety Manual. CH. 6 - Hydrogen. Document GRC-MQSA.001, marzo de 2006. [1]
- ↑ Milenko, Y. Y., Sibileva, R. M., Strzhemechny, M. A. (1997). «Natural ortho-para conversion rate in liquid and gaseous hydrogen.» J Low Temp Phys 107(1-2):77-92.
- ↑ Svadlenak, R. E., Scott, A. B. (1957). «The Conversion of Ortho-to Parahydrogen on Iron Oxide-Zinc Oxide Catalysts.» J Am Chem Soc 79(20); 5385-5388.
- ↑ «H3+ Resource Centre». Universitarios de Sibilinos y Chicano= 9 de febrero de 2007.
- ↑ Weir, S. T.; A. C. Mitchell y W. J. Nellis (1996). «Metallization of fluid molecular hydrogen at 140 GPa (1.4 Mbar)». Physical Review Letters (en inglés) 76: 1860. doi:10.1103/PhysRevLett.76.1860.
- ↑ Moers, K. (1920). 2. Z. Anorg. Allgem. Chem., 113:191.
- ↑ Downs, A. J., Pulham, C. R. (1994). «The hydrides of aluminium, gallium, indium, and thallium: a re-evaluation.» Chem Soc Rev 23:175-83.
- ↑ Hibbs, D. E., Jones, C., Smithies, N. A. (1999). «A remarkably stable indium trihydride complex: synthesis and characterization of [InH3{P(C6H11)3}].» Chem Commum 185-6.
- ↑ Okumura. M., Yeh, L. I., Myers, J. D., Lee, Y. T. (1990). «Infrared spectra of the solvated hydronium ion: vibrational predissociation spectroscopy of mass-selected H3O+•H2On•H2m.»
- ↑ Perdoncin, G., Scorrano, G. (1977). «Protonation equilibria in water at several temperatures of alcohols, ethers, acetone, dimethyl sulfide, and dimethyl sulfoxide.» 99(21); 6983-6986.
- ↑ Carrington, A., McNab, I. R. (1989). «The infrared predissociation spectrum of triatomic hydrogen cation (H3+).» Accounts of Chemical Research 22:218-22.
- ↑ Cammack, Richard; Robson, R. L. (2001). Hydrogen as a Fuel: Learning from Nature. Taylor & Francis Ltd. ISBN 0415242428.
- ↑ Kruse, O.; Rupprecht, J.; Bader, K.-P.; Thomas-Hall, S.; Schenk, P. M.; Finazzi, G.; Hankamer, B (2005). «Improved photobiological H2 production in engineered green algal cells». The Journal of Biological Chemistry. 40 280: 34170-7. PMID 16100118. doi:10.1074/jbc.M503840200.
- ↑ Smith, H. O.; Xu, Q. (2005). «IV.E.6 Hydrogen from Water in a Novel Recombinant Oxygen-Tolerant Cyanobacteria System» (PDF). FY2005 Progress Report. United States Department of Energy. Consultado el 28 de noviembre de 2008.
- ↑ Williams, Chris (24 de febrero). «Pond life: the future of energy». Science (The Register). Consultado el 28 de noviembre de 2008.
- ↑ Kruse, B.; Grinna, S.; Buch, C. (2002). «Hydrogen Status og Muligheter» (PDF). Bellona. Archivado desde el original el 16 de febrero de 2008. Consultado el 12 de febrero de 2008.
- ↑ Emil, Venere (15 de mayo de 2007). «New process generates hydrogen from aluminum alloy to run engines, fuel cells». Purdue University. Archivado desde el original el 1 de febrero de 2008. Consultado el 5 de febrero de 2008.
- ↑ a b Oxtoby, D. W. (2002). Principles of Modern Chemistry (5th edition edición). Thomson Brooks/Cole. ISBN 0030353734.
- ↑ «Hydrogen Properties, Uses, Applications». Universal Industrial Gases, Inc. 2007. Consultado el 11 de marzo de 2008.
- ↑ Lees, Andrew (2007). «Chemicals from salt». BBC. Archivado desde el original el 12 de marzo de 2005. Consultado el 11 de marzo de 2008.
- ↑ «Development of solar-powered thermochemical production of hydrogen from water» (PDF). Archivado desde el original el 27 de octubre de 2012. Consultado el 28 de octubre de 2013.
- ↑ Perret, Robert. «Development of Solar-Powered Thermochemical Production of Hydrogen from Water, DOE Hydrogen Program, 2007» (PDF). Archivado desde el original el 27 de octubre de 2012. Consultado el 17 de mayo de 2008.
- ↑ Hirschler, M. M. (2000). Electrical Insulating Materials: International Issues. ASTM International. pp. 89-. ISBN 978-0-8031-2613-8. Consultado el 13 de julio de 2012.
- ↑ Chemistry Operations (15 de diciembre). «Hydrogen». Los Alamos National Laboratory. Archivado desde el original el 16 de diciembre de 2008. Consultado el 12 de diciembre de 2008.
- ↑ Durgutlu, Ahmet (27 de octubre). «Experimental investigation of the effect of hydrogen in argon as a shielding gas on TIG welding of austenitic stainless steel». ScienceDirect. 1 (Ankara, Turkey: Gazi University) 25: 19-23. doi:10.1016/j.matdes.2003.07.004. Consultado el 12 de diciembre de 2008.
- ↑ «Atomic Hydrogen Welding». Specialty Welds. 2007. Archivado desde el original el 10 de diciembre de 2008. Consultado el 12 de diciembre de 2008.
- ↑ Hardy, Walter N. (19 de marzo). «From H2 to cryogenic H masers to HiTc superconductors: An unlikely but rewarding path». Physica C: Superconductivity (Vancouver, Canadá: University of British Columbia). 388-389: 1-6. doi:10.1016/S0921-4534(02)02591-1. Archivado desde el original el 1 de diciembre de 2008. Consultado el 12 de diciembre de 2008.
- ↑ Barnes, Matthew (2004). «LZ-129, Hindenburg». The Great Zeppelins. Archivado desde el original el 27 de diciembre de 2012. Consultado el 12 de diciembre de 2008.
- ↑ Block, Matthias (3 de octubre). «Hydrogen as Tracer Gas for Leak Detection». 16th WCNDT 2004. Montreal, Canada: Sensistor Technologies. Consultado el 12 de diciembre de 2008.
- ↑ «Report from the Commission on Dietary Food Additive Intake» (PDF). European Union. Consultado el 12 de diciembre de 2008.
- ↑ Reinsch, J.; A. Katz, J. Wean, G. Aprahamian, J. T. MacFarland (octubre de 1980). «The deuterium isotope effect upon the reaction of fatty acyl-CoA dehydrogenase and butyryl-CoA». J. Biol. Chem. 255 (19): 9093-97. PMID 7410413. Archivado desde el original el 15 de abril de 2008. Consultado el 14 de diciembre de 2008.
- ↑ Bergeron, Kenneth D. (enero-febrero de 2004). «The Death of no-dual-use». Bulletin of the Atomic Scientists (Educational Foundation for Nuclear Science, Inc.) 60 (1): 15. doi:10.2968/060001004. Consultado el 14 de diciembre de 2008.
- ↑ Holte, Aurali E.; Houck, Marilyn A.; Collie, Nathan L. (3 de noviembre de 2004). «Potential Role of Parasitism in the Evolution of Mutualism in Astigmatid Mites». Experimental and Applied Acarology (Lubbock: Texas Tech University) 25 (2): 97-107. doi:10.1023/A:1010655610575. Consultado el 8 de marzo de 2008.
- ↑ Quigg, Catherine T. (marzo de 1984). «Tritium Warning». Bulletin of the Atomic Scientists (Chicago) 40 (3): 56-57. ISSN 0096-3402. Consultado el 14 de diciembre de 2008.
- ↑ «International Temperature Scale of 1990» (PDF). Procès-Verbaux du Comité International des Poids et Mesures: T23-T42. 1989. Consultado el 15 de diciembre de 2008.
- ↑ a b c McCarthy, John (31 de diciembre de 1995). «Hydrogen» (en inglés). Stanford University. Archivado desde el original el 14 de marzo de 2008. Consultado el 15 de diciembre de 2008.
- ↑ «Nuclear Fusion Power». World Nuclear Association. Mayo de 2007. Archivado desde el original el 25 de diciembre de 2012. Consultado el 15 de diciembre de 2008.
- ↑ «Chapter 13: Nuclear Energy — Fission and Fusion». Energy Story (en inglés). California Energy Commission. 2006. Archivado desde el original el 2 de marzo de 2008. Consultado el 15 de diciembre de 2008.
- ↑ «DOE Seeks Applicants for Solicitation on the Employment Effects of a Transition to a Hydrogen Economy». Hydrogen Program (en inglés) (US Department of Energy). 22 de marzo de 2006. Archivado desde el original el 19 de julio de 2011. Consultado el 15 de diciembre de 2008.
- ↑ a b «Carbon Capture Strategy Could Lead to Emission-Free Cars» (en inglés). Georgia Tech. 11 de febrero de 2008. Consultado el 15 de diciembre de 2008.
- ↑ Heffel, James W. «NOx emission and performance data for a hydrogen fueled internal combustion engine at 1500 rpm using exhaust gas recirculation». International Journal of Hydrogen Energy (en inglés) (Riverside, CA: University of California) 28 (8): 901-908. doi:10.1016/S0360-3199(02)00157-X. Archivado desde el original el 2 de diciembre de 2008. Consultado el 15 de diciembre de 2008.
- ↑ Ver Romm, Joseph J. (2004). The Hype About Hydrogen: Fact And Fiction In The Race To Save The Climate (en inglés) (1era edición edición). Island Press. ISBN 155963703X.
- ↑ https://www.bbc.com/mundo/noticias-56531777
- ↑ Le Comber, P. G.; Jones, D. I. e Spear, W. E. (1977). «Hall effect and impurity conduction in substitutionally doped amorphous silicon». Philosophical Magazine (en inglés) 35 (5): 1173-1187.
- ↑ Van de Walle, Chris G. (2000). «Hydrogen as a cause of doping in zinc oxide». Physical Review Letters (en inglés) 85 (5): 1012-1015.
- ↑ Janotti, Anderson; Van de Walle, Chris G. (2007). «Hydrogen multicentre bonds». Nature Materials (en inglés) 6: 44-47.
- ↑ Kilic, Cetin; Zunger, Alex (2002). «n-type doping of oxides by hydrogen». Applied Physics Letters (en inglés) 81 (1): 73-75.
- ↑ Peaconck, P. W.; Robertson, J. (2003). «Behavior of hydrogen in high dielectric constant oxide gate insulators». Applied Physics Letters (en inglés) 83 (10): 2025-2027.
- ↑ a b Brown, W. J. et al.; Xu, Q (1997). «Safety Standard for Hydrogen and Hydrogen Systems» (PDF) (en inglés). NASA. Archivado desde el original el 16 de febrero de 2013. Consultado el 1º de diciembre de 2008.
- ↑ «Liquid Hydrogen MSDS» (PDF). Praxair, Inc. Septiembre de 2004. Archivado desde el original el 27 de mayo de 2008. Consultado el 1 de diciembre de 2008.
- ↑ «'Bugs' and hydrogen embrittlement». Science News. 3 (Washington D. C.) 128: 41. 20 de septiembre. ISSN 0036-8423. doi:10.2307/3970088. Consultado el 1º de diciembre de 2008.
- ↑ «Hydrogen Safety». Humboldt State University. Archivado desde el original el 17 de febrero de 2008. Consultado el 1º de diciembre de 2008.
Bibliografía adicional
[editar]- Cotton, F. A.; Wilkinson, G. Advanced Inorganic Chemistry: a comprehensive text, fourth edition. John Wiley & Sons. 1980. ISBN 0-471-02775-8
- Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements, second edition. Butterworth - Heinemann. 1997 ISBN 0-7506-3365-4
- Gutiérrez Ríos, E. Química Inorgánica. Reverté. 1994. ISBN 84-291-7215-7
- Shriver, D. F.; Atkins, P. W.; Langford, C. H. Química Inorgánica, Vol. 1 Segunda edición. Reverté. 1997 ISBN 84-291-7004-9
- Interacciones cuadripolares en SrZrO3
Enlaces externos
[editar]Wikiquote alberga frases célebres de o sobre Hidrógeno.
Wikimedia Commons alberga una galería multimedia sobre Hidrógeno.
Wikcionario tiene definiciones y otra información sobre hidrógeno.
- WebElements.com (en inglés)
- EnvironmentalChemistry.com (en inglés)
- Es Elemental
- Modelo del átomo de hidrógeno en escala
- Cálculos Básicos de Hidrógeno en la Mecánica Cuántica
- Asociación Nacional de Hidrógeno
- Actualidad sobre el uso del hidrógeno en coches
- Imágenes del Átomo de Hidrógeno Archivado el 25 de marzo de 2016 en Wayback Machine.
- El hidrógeno como combustible
- El hidrógeno, el combustible del futuro

