Toriumdioksidi
| Toriumdioksidi | |
|---|---|
 |
|
| Tunnisteet | |
| CAS-numero | |
| PubChem CID | |
| Ominaisuudet | |
| Molekyylikaava | ThO2 |
| Moolimassa | 264,04 g/mol |
| Ulkomuoto | Valkoista tai keltaista kiteistä ainetta[1] |
| Sulamispiste | 3 390 °C (3 663 K)[2][3] |
| Kiehumispiste | 4 400 °C (4 673 K)[3][4] |
| Tiheys |
10,0 g/cm3[3][4] 9,86 g/cm3[1] |
| Liukoisuus veteen | Ei liukene[1] |
Toriumdioksidi (ThO2) on torium- ja oksidi-ionien muodostama epäorgaaninen ioniyhdiste. Yhdistettä esiintyy luonnossa monatsiittimineraalissa.
Ominaisuudet
[muokkaa | muokkaa wikitekstiä]Toriumdioksidin kiderakenne on alkeiskopiltaan kuutiollinen ja muistuttaa fluoriittimineraalin rakennetta. Se voi esiintyä myös kolloidisina muotoina, joiden rakenne voidaan esittää kaavalla ThO2·nH2O. Aineen sulamispiste on 3 390 °C, joka on korkein millään oksideista. Oksidin tiheys on hyvin lähellä metallisen toriumin tiheyttä, mikä johtuu toriumdioksidin välisijayhdisteluonteesta. Toriumin tavoin myös toriumdioksidi on radioaktiivinen aine.[2][5]
Valmistus
[muokkaa | muokkaa wikitekstiä]Toriumdioksidia voidaan erottaa monatsiitista, mutta sitä valmistetaan myös toriumnitraatista, -hydroksidista, -peroksidista, -karbonaatista ja -oksalaatista. Toriumnitraatista saadaan toriumdioksidia käsittelemällä se ensin oksaalihapolla, jolloin muodostuu toriumoksalaattia. Toriumoksalaatti hajoaa 600 °C lämpötilassa toriumdioksidiksi, hiilidioksidiksi ja vedeksi.[1][2][5]
Käyttö
[muokkaa | muokkaa wikitekstiä]
Toriumdioksidia käytetään hehkusukissa, optisessa lasissa ja katalyyttinä hiilivetyjen krakkauksessa alumiinioksidikantajalla. Metallista toriumia voidaan valmistaa pelkistämällä oksidia kalsiummetallin avulla ja toriumdioksidista valmistetaan myös muita toriumyhdisteitä.[1][2][5]
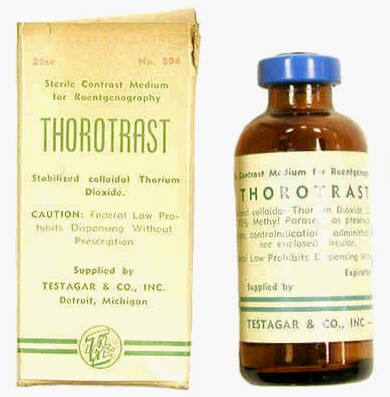
Toriumdioksidi tuli lääketieteelliseen käyttöön vuonna 1928 kolloidina nimeltä Thorotrast. Sitä käytetään erityisesti 1930–1940-luvulla röntgenkuvauksen apuna varjoaineena. Toriumdioksidi on heikosti radioaktiivista ja sen biologinen puoliintumisaika ihmisen elimistössä on yli 400 vuotta. Thororastin havaittiin aiheuttavan maksasyöpää ja leukemiaa, minkä vuoksi sen käyttö röntgenkuvauksissa lopetettiin.[6][7]
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c d e E. M. Karamäki: Epäorgaaniset kemikaalit, s. 510. Kustannusliike Tietoteos, 1983. ISBN 951-9035-61-3
- ↑ a b c d David L. Clark, Mary P. Neu, Wolfgang Runde & D. Webster Keogh : "Thorium and Thorium Compounds", teoksessa Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2001.
- ↑ a b c Yaws, Carl L.: The Yaws Handbook of Physical Properties for Hydrocarbons and Chemicals, s. 802. Gulf Professional Publishing, 2015. ISBN 0128011467 Kirja Googlen teoshaussa (viitattu 6.4.2018). (englanniksi)
- ↑ a b Haynes, William M. (toim.): CRC Handbook of Chemistry and Physics, s. 4–90. (97. painos) CRC Press, 2016. ISBN 9781439814628 Kirja Googlen teoshaussa (viitattu 5.4.2018). (englanniksi)
- ↑ a b c Wolfgang Stoll: "Thorium and Thorium Compounds", teoksessa Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2002.
- ↑ Anssi Auvinen: ”7”, Säteilyepidemiologia, s. 105. (Kirjassa Säteilyn terveysvaikutukset) Stuk, 2002. ISBN 951-712-499-6 Kirjan verkkoversio (viitattu 22.1.2011).
- ↑ Mauno Härkönen, Rolf Tarvala, Olli Savolainen, Johan Wennström & Eeva-Liisa Lakomaa: Thorotrast ja maksasyöpä. Duodecim, 1981, 97. vsk, s. 960–962. Artikkelin verkkoversio. (PDF) Viitattu 22.1.2011.
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä]- PubChem: Thorium oxide (englanniksi)